Новые данные о старой биофизической проблеме: Неструктурированные домены белков тубулинов модулируют сборку цитоскелетных микротрубочек
В отличие от неорганических (неживых) систем, подавляющее большинство биологических систем находятся всегда вдали от термодинамического равновесия благодаря непрерывному потреблению энергии, которое им требуется для изоляции от окружающей среды и поддержания внутренней упорядоченности.
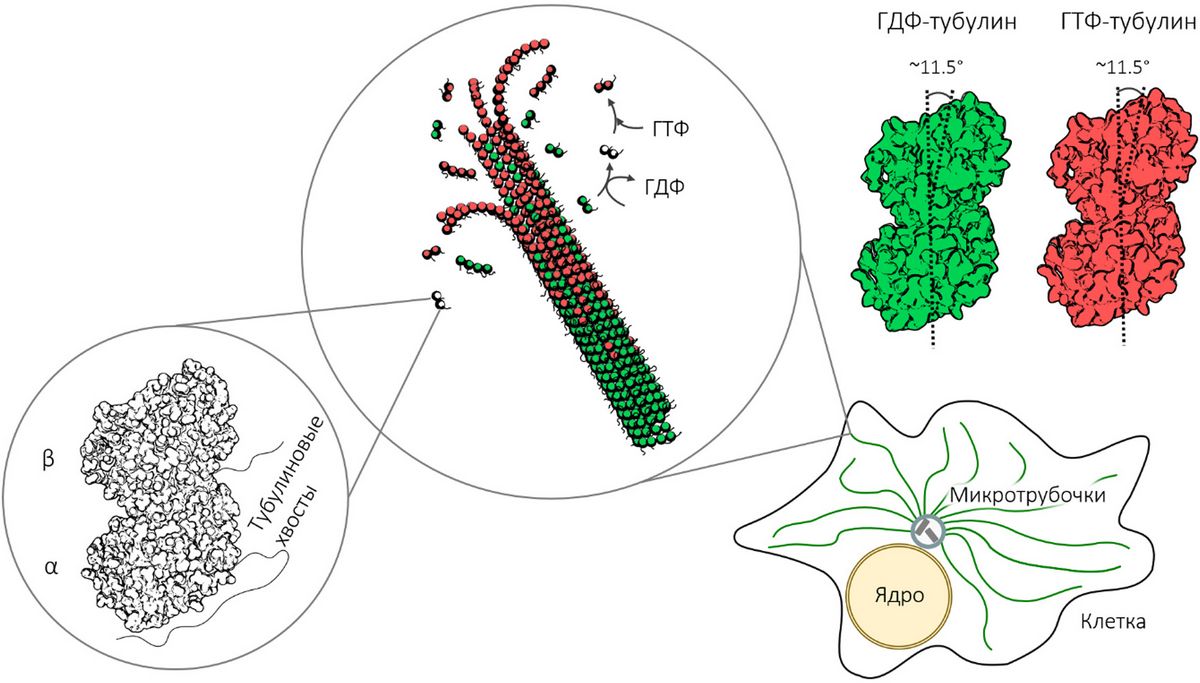
Микротрубочки и тубулины. В центре показана микротрубочка крупным планом. На ее конце происходит присоединение и отсоединение субъединиц, из которых она состоит — димеров и олигомеров тубулинов.
Слева крупным планом показан димер тубулина и его неструктурированные С-концевые «хвосты». Справа показаны изогнутые димеры тубулинов, связанные с молекулами ГТФ и ГДФ, а также расположение микротрубочек внутри живой клетки
Примером такой белковой системы являются микротрубочки — полимеры димерного белка тубулина, имеющие форму полого цилиндра диаметром 25 нм и длину порядка десятков микрометров в клетках. Сборка микротрубочек из тубулинов является энтропийно-движимым процессом, протекающим самопроизвольно при температуре и концентрации выше критических. Однако через некоторое время после начала сборки микротрубочки могут, перейдя через кинетический барьер, переключиться на обратный процесс — деполимеризацию. При этом, как правило, микротрубочка полностью разбирается, последовательно отсоединяя тысячи субъединиц тубулинов от своего конца. Для того чтобы это переключение, называемое катастрофой, случилось, критическое число тубулинов в составе микротрубочки должно потратить энергию, запасающуюся в макроэргических связях молекулы гуанозинтрифосфата (ГТФ) и, таким образом, отдалиться от равновесного состояния. Такое бистабильное поведение микротрубочек получило название «динамической нестабильности». Оно позволяет клетке эффективно выполнять множество функций. К примеру, микротрубочки могут быстро построить внутреннюю сеть клетки и служить «рельсами» для моторных белков, тем самым способствуя организации внутриклеточного транспорта. Благодаря своей большой жесткости, близкой к жесткости оргстекла, микротрубочки могут стабильно поддерживать форму клетки. Форма клетки может меняться во время клеточной миграции или дифференцировки клеток, при которых весь внутренний скелет клетки (цитоскелет), включая микротрубочки, должен за короткий срок перестроиться с большими затратами энергии. В процессе деления клетки микротрубочками совершается механическая работа по перемещению хромосом за счет сил, прикладываемых концами микротрубочек. При этом две микротрубочки, присоединенные с двух сторон к хромосоме, должны переместить ее в сторону одного из полюсов клетки. Для этого одна микротрубочка деполимеризуется, превращая химическую энергию ГТФ в механическую работу. Через сопрягающий комплекс белков она передает силу на микротрубочку, находящуюся по другую сторону хромосомы, для ускорения полимеризации и синхронизации движения всего комплекса.
Как уже было упомянуто, в цитоплазме клетки белки-тубулины связаны с молекулами ГТФ. Ранее считалось, что причиной спонтанной потери стабильности микротрубочек и перехода их от сборки к разборке является изменение формы тубулинов в результате процесса гидролиза ГТФ до гуанозиндифосфата (ГДФ). В частности, тубулины в комплексе с молекулами ГТФ при сборке предполагались более прямыми и поэтому «более подходящими» для построения микротрубочки, а ГДФ-тубулины — более изогнутыми. Эта модель подразумевала разный вид концов микротрубочек во время сборки и разборки. Однако в 2018–2020 годах, используя криоэлектронную томографию, мы и американские коллеги из Университета Колорадо обнаружили, что цепочки из тубулинов на концах микротрубочек всегда изогнуты, подразумевая, что различие между ГТФ- и ГДФ-тубулинами кроется не в их кривизне [1]. Чтобы объяснить эти данные, ими была предложена новая модель сборки микротрубочки, согласно которой удлинение микротрубочки происходит за счет смыкания изогнутых цепочек тубулина на растущем конце, которые часто выпрямляются и смыкаются благодаря тепловым колебаниям [2]. Детальное полно-атомное моделирование таких цепочек тубулинов с помощью метода молекулярной динамики в соавторстве с коллегами биологического факультета МГУ подтвердило сходство кривизны ГТФ- и ГДФ тубулинов [3]. Этот подход представляет белки как совокупность частиц (то есть атомов, включая атомы воды и ионов), движения и взаимодействия которых описываются в рамках классической ньютоновской динамики. На основе расчетов мы пришли к выводу, что присутствие молекулы ГТФ внутри тубулина делает связь между его димерами более гибкой, позволяя легче встраиваться в тело микротрубочки, несмотря на присущую этому белку кривизну. Это дает новый молекулярный механизм для переключения микротрубочек от сборки к разборке.
В мае 2021 года, вновь в сотрудничестве с биофизиками биологического факультета и еще с американскими коллегами из Национального института здоровья (NIH, USA), мы обнаружили, что не только глобулярные участки белков, имеющие четкую структуру и достаточно большую жесткость, могут влиять на поведение микротрубочек. Помимо них белки-тубулины несут еще и неструктурированные высокозаряженные С-концевые полипептидные «хвосты», роль которых при сборке микротрубочек была непонятна. На основе экспериментов с использованием методов генной инженерии и оптической микроскопии наша команда обнаружила, что удаление С-концевых хвостов тубулинов почти вдвое ускоряет сборку микротрубочек [4]. Объяснение этому неинтуитивному результату было дано в рамках метода молекулярной динамики. Вычисления показали, что С-концевые неструктурированные участки тубулинов, несущие отрицательные заряды, взаимодействуют с положительно заряженными интерфейсами на торцах димеров тубулинов, блокируя возможность присоединения тубулинов друг к другу. Это, по всей видимости, и замедляет сборку микротрубочек. Вероятно, такое блокирование заложено в клетках как возможность ускорения роста микротрубочек за счет дополнительных белков, которые будут связываться с неструктурированным С-концом тубулина и освобождать от него межтубулиновый интерфейс и тем самым обеспечивать более быструю сборку микротрубочек при необходимости.
Литературные источники:
[1] McIntosh J.R., O’Toole E., Morgan G., Austin J., Ulyanov E., Ataullakhanov F. and Gudimchuk N. (2018). Microtubules grow by the addition of bent guanosine triphosphate tubulin to the tips of curved protofilaments. J. Cell Biol. 217, 2691–2708.
https://istina.msu.ru/publications/article/124161684/
[2] Gudimchuk N.B., Ulyanov E.V., O’Toole E., Page C.L., Vinogradov D.S., Morgan G., Li G., Moore J.K., Szczesna E., Roll-Mecak A. et al. (2020). Mechanisms of microtubule dynamics and force generation examined with computational modeling and electron cryotomography. Nature Communications 11, 3765.
https://istina.msu.ru/publications/article/314003006/
[3] Fedorov V.A., Orekhov P.S., Kholina E.G., Zhmurov A.A., Ataullakhanov F.I., Kovalenko I.B., and Gudimchuk N.B. (2019). Mechanical properties of tubulin intra- and inter-dimer interfaces and their implications for microtubule dynamic instability. PLOS Computational Biology. 15, 8, e1007327
https://istina.msu.ru/publications/article/230015245/
[4] Chen J., Kholina E., Szyk A., Fedorov V.A., Kovalenko I., Gudimchuk N. and Roll-Mecak A. (2021). ?-tubulin tail modifications regulate microtubule stability through selective effector recruitment, not changes in intrinsic polymer dynamics. Developmental Cell.
https://istina.msu.ru/publications/article/371649126/
с.н.с. кафедры биофизики физического факультета МГУ Гудимчук Н.Б., м.н.с. кафедры биофизики физического факультета МГУ Александрова В.В.








